
آمونیاک
١٤٠٣/٢/٢٠
آمونیاک چیست؟
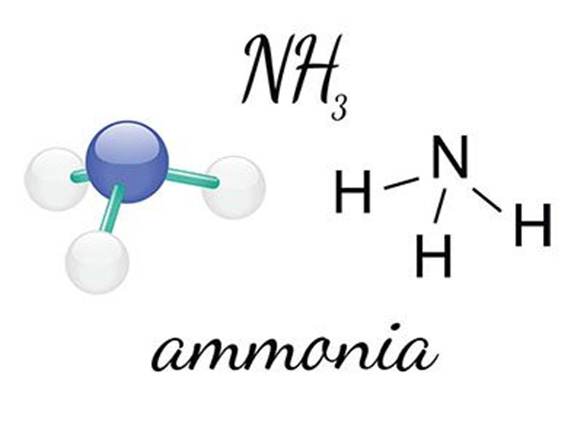
قرار گیری حروف و ارقام NH3 در کنار یکدیگر؛ نشان دهنده گاز فاقد رنگ اما صاحب بوی مشخص آمونیاک است که متشکل گروهی از اتمهای نیتروژن و هیدروژن می باشد. آمونیاک را میتوان نوعی ماده شیمیایی تلقی نمود که به میزان اندکی در طبیعت یافت می گردد و وابسته به مواد نیتروژن دار حیوانی و گیاهی به تولید می رسد. این ماده و نمک های آمونیوم به میزان محدودی در آب باران یافت می شود، در صورتی که کلرید آمونیوم و سولفات آمونیوم در مکان های آتشفشانی دیده شده اند. در ادامه با اشاره به ویژگی های فیزیکی و همینطور شیمیایی آن، بیشتر با این ماده آشناییت خواهیم یافت.
ویژگی های فیزیکی و شیمیایی آمونیاک
- وزن
آمونیاک با ویژگی هایی چون بی آب یک گاز مایع، بی رنگ و غیر قابل اشتعال معرفی می گردد. وزن این بخار از هوا سبک تر و رایحه ای به شدت تندی نوع خانگی را داراست. از بعد شیمیایی این ماده دارای 82 درصد نیتروژن و 18 درصد هیدروژن می باشد.
- واکنش به آب
این ماده هیدروسکوپی (آب دوست) قادر است تا یک فوت مکعب آب 1300 فوت مکعب بخار آمونیاک را حل نماید. در چنین حالتی آب را به سلاحی نخستین برای اولین پاسخ دهندگان مبدل می سازد.
- اشتعال پذیری
درست است که از آمونیاک در دسته گاز های غیر قابل اشتعال قرار می گیرد ولی چنانچه در معرض دمای 1204 درجه فارنهایت در محدوده غلظت بخار بین 15 تا 28 درصد باشد، مشتعل می گردد.
- خورندگی
آمونیاک در فلزات گالوانیزه، چدن، مس، برنج یا آلیاژهای مس، به خورندگی در آن ها اطلاق می گردد.
نقطه جوش
آمونیاک مایع در صورتی که در هر میزان دمای بالاتر از 28- درجه فارنهایت قرار گیرد به جوش می رسد و نزدیک به 850 برابر حجم مایع خود انبساط می گردد.
- فشار و دما
در هر زمان که مایعی در ظرفی کاملا بسته، با دخالت دمایی بالاتر از نقطه جوش آن حبس گردد، فشار با امکان اندازه گیری بر دیواره های محدود کننده نمایان خواهد گشت.
- ساختار
مولکول های آمونیاک دارای قالبی هرمی هستند و اتم نیتروژن را در راس خود جای داده اند. این مولکول ها همواره به صورت وارونه حرکت می کنند در حالی که اتم نیتروژن از صفحه سه اتم هیدروژن مثل یک چتر عبور و در باد به چرخش در می آید.

کاربرد آمونیاک
البته که کاربرد های این ماده در بعد صنعتی و خانگی از تعداد انگشت شمار عبور میکنند. در این قسمت تنها به توضیح موارد برجسته آن خواهیم پرداخت:
- آمونیاک در کود شیمیایی:
زمانی که این ماده به خاک ورود پیدا کند، به افزایش قابل توجه عملکرد محصول چون ذرت و گندم اطلاق خواهد گشت.
- ساخت ترکیبات نیتروژن دار:
آمونیاک مستقیم و غیر مستقیم در تولید اغلب ترکیبات دارای نیتروژن استفاده می شوند. برای مثال اسید نیتریک به جهت تولید کودها، مواد منفجره و … بکار گرفته می شود.
- استفاده برای شستشو:
آمونیاک خانگی محلول NH3 در آب می باشد که خاصیت تمیز کنندگی عمومی برای تمامی سطوح را داراست. وابسته به شفافیتی که این ماده ایجاد می سازد، یکی از بهترین انواع تمیز کننده به جهت تمیز نمودن شیشه، ظروف چینی و فولاد ضد زنگ به حساب می آید. ناگفته نماند که این ماده بهترین شیوه برای پاک سازی کوره ها و نابودی کامل باقی مانده ذرات به حساب می آید.
- اصلاح انتشار گازها:
از آمونیاک برای پاکسازی SO2 حاصل از سوخت های فسیلی استفاده می شود و محصول حاصل برای استفاده به سولفات آمونیوم مبدل می گردد.این ماده، آلاینده های اکسید نیتروژن که توسط موتورهای دیزلی تولید می شود را خنثی می کند که این فرآیند کاهش کاتالیزوری انتخابی نامیده می شود.
- به عنوان سوخت:
چگالی انرژی خام آمونیاک مایع مقدار MJ/L 11.5 را به خود اختصاص می دهد. به همین سبب تولید گشتن هیدروژن از این ماده، فرصتی را فراهم می آورد تا در سلول های سوختی هیدروژن یا به شکل کاملا مستقیم در سلول های سوختی با درجه حرارت بالا مورد استفاده قرار گیرد. مبدل گشتن آمونیاک به هیدروژن از روش فرآیند سدیم آمید برای مصارفی همانند احتراق و یا به جهت سوخت در سلول های غشایی تبادل پروتون قابلیت مصرف دارند.
- آمونیاک به عنوان محرک تنفسی:
بخار آزاد گشته از این ماده، در قالب یک محرک تنفسی صاحب کاربرد چشمگیری است.
- کاربرد در تولید خنک کننده ها:
وابسته به خواص حاکم در تبخیر آمونیاک، نوعی ماده بسیار مفیدی به جهت خنک کنندگی به حساب می آید. این محصول به شکل کاملا خشک به سبب بهره وری بالای انرژی و هزینه کم در کاربردهای برودتی صنعتی کاربرد دارد.
- استفاده در تخمیر کننده ها
- منسوجات
- گاز بالابر
- صنایع چوب
